El sistema inmune de las mucosas de las aves es responsable de conferir inmunidad local en el epitelio de los tractos respiratorio, gastrointestinal y digestivo. El conjunto más importante de los activos inmunes de las mucosas es proveniente del llamado MALT (tejido linfoide asociado a la mucosa), y más específicamente del llamado GALT (Tejido Linfoide Asociado al Intestino) presente en los intestinos de las aves.
El GALT representa más del 80% de todos los linfocitos responsables de la respuesta inmunitaria adaptativa que ocurre cuando las células derivadas de los linfocitos B producen grandes cantidades de Inmunoglobulina A secretora (sIgA), cuando un agente externo está invadiendo la mucosa del ave.
En el campo de la vacunología en la producción avícola moderna, a menudo nos enfrentamos a creencias conceptuales que subestiman la contribución crítica de la sIgA para neutralizar los desafíos de campo.
La respuesta humoral local impulsada por las sIgA es complementaria a otros mecanismos importantes que se esperan después de la vacunación oral con vacunas vivas, como el efecto de inhibición de la colonización y la respuesta mediada por células.
En este contexto, la siguiente revisión técnica tiene como objetivo explicar los aspectos clave de la importancia de las sIgA, su modo de acción y el papel de las vacunas vivas en la amenaza de los patógenos transmitidos por los alimentos, como Salmonella.
¿POR QUÉ LA IgA SECRETORA ES IMPORTANTE?
Las cepas salvajes de Salmonella pueden transmitirse verticalmente, desde las reproductoras a la progenie, sin embargo, la ruta horizontal también se considera crítica, teniendo en cuenta las múltiples fuentes de infección involucradas y la capacidad de las bacterias para colonizar el intestino como resultado de la transmisión fecal-oral.
Por lo tanto, la inmunidad de la mucosa representa una defensa importante.
La importancia de esta respuesta local en el intestino reside en el potencial para producir hasta 100 mg/kg de peso corporal/día de sIgA, que es significativamente mayor en comparación con los 30 mg/kg de peso corporal/día derivados de la IgG circulante (o IgY en aves).
Estos títulos ayudan a prevenir la adhesión bacteriana a la superficie de la mucosa intestinal, inhibiendo así la colonización de organismos patógenos, complementando el efecto neutralizante de la respuesta sistémica conferida por el sistema inmune celular mediado por células T.
A diferencia de otros anticuerpos, la IgA secretora es abundante en la mucosa, siendo resistente a la actividad catabólica de las proteasas presentes en estos sitios.
En consecuencia, los desafíos de Salmonella cuya vía de entrada en el organismo es la ruta fecal-oral llegando a la mucosa intestinal, al encontrarse con la sIgA en este sitio serán neutralizados, reduciendo así significativamente la presión de invasión en el ave y llevando, a su vez, a una menor excreción del patógeno en el ambiente.
Por consiguiente, la producción de sIgA desencadenada por vacunas vivas atenuadas juega un papel importante en la reducción de la colonización intestinal, invasión de órganos, excreción y diseminación en el medio ambiente.
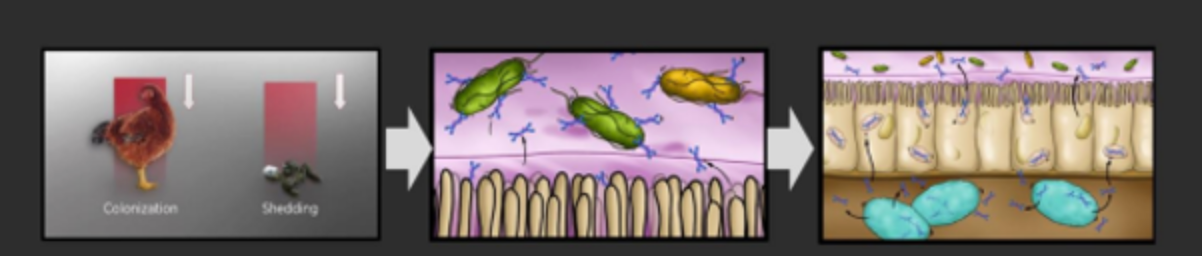
- La transmisión de Salmonella en granjas avícolas ocurre principalmente de forma horizontal, por vía fecal-oral
- La IgA secretora inhibe la adherencia de la Salmonella invasora, impidiendo así su colonización intestinal
- La respuesta de la IgA secretora es posible principalmente con vacunas orales (la respuesta de las vacunas inactivadas se limita a los anticuerpos circulantes)
¿CÓMO ACTUA LA IgA SECRETORA EN EL INTESTINO?
El tejido linfoide asociado al intestino (GALT), que contiene las placas de Peyer, es reconocido como el principal sitio inductor de respuesta inmune contra los patógenos que descienden por el tracto intestinal, por vía oral, resultando en la producción de IgA.
- Las Salmonellas paratíficas, con sus característicos flagelos, son captadas por células M intestinales e invaden el epitelio intestinal.
- Cuando llegan a las placas de Peyer, las bacterias invasoras pueden activar las células B involucradas en la producción de IgA local.
- Siguiendo el mismo principio, las cepas vivas atenuadas son capturadas por las células dendríticas intestinales (fagocíticas) al llegar a la mucosa intestinal, que modula las señales coestimuladoras necesarias para iniciar la respuesta sIgA local.
Al comparar animales SPF, libres de bacterias intestinales, con animales que presentan colonización intestinal por vía de una cepa vacunal viva, se puede encontrar en estos últimos el doble de la cantidad de células productoras de IgA.
Por ello, la inmunización temprana desde el primer día de vida con vacuna viva de Salmonella favorece la madurez de la capacidad de respuesta del animal a través de una mayor producción de células plasmáticas productoras de IgA, y la calidad de esta respuesta será estimulada por las posteriores inmunizaciones administradas durante la vida del ave.
- En este contexto, las IgA juegan un papel importante en el bloqueo específico de la adherencia de patógenos al epitelio intestinal.
Estudios recientes con aves vacunadas con una vacuna viva y desafiadas oralmente con Salmonella Typhimurium demuestran claramente las diferencias en términos de respuesta de IgA, en comparación con animales no vacunados.
- En condiciones controladas, los resultados demuestran la eficacia de la IgA desencadenada por vacunas vivas para controlar la colonización intestinal y reducir la excreción y propagación ambiental de la bacteria, hallazgo que es consistente con experiencias de campo realizadas a nivel mundial, que indican que la administración de vacunas vivas atenuadas de Salmonella al menos 3 veces durante el período de cría (según la indicación de la etiqueta), es el principal estímulo capaz de generar la producción de estas IgAs secretoras.
- Teniendo en cuenta lo anterior, la medición de IgAs en la mucosa a través de los antígenos somáticos y de flagelos de muestras de hisopos cloacales es un excelente indicador del nivel de respuesta inmune contra patógenos específicos, tanto para vacunaciones de mucosas como contra patógenos salvajes.
¿QUÉ ESPERAR DE UNA VACUNA VIVA BIVALENTE EN TÉRMINOS DE RESPUESTA HUMORAL LOCAL?
La IgA secretora es solo un activo específico derivado de la respuesta humoral local, por lo que es crucial para la eliminación temprana de bacterias entéricas como la Salmonella.
- La acción de las IgAs en neonatos está ampliamente demostrada como imprescindible para una defensa de por vida eficaz desarrollada por el animal.
- De este modo, experiencias de campo adicionales realizadas en reproductoras y ponedoras indican que el antígeno somático (O) y el antígeno flagelar (H) presentes en una vacuna viva bivalente son capaces de inducir títulos de IgA más altos (valores medios), en comparación con una vacuna viva de SE monovalente, después de probar hisopos cloacales.
- Además, estos títulos aumentan sustancialmente a medida que se administran dosis posteriores durante el período de cría, con la primera dosis administrada en la semana 1 de edad, la segunda en la semana 6 de edad y la tercera dosis en la semana 16 de edad.
La investigación aplicada también demostró que la formación de inmunocomplejos, necesarios para la eliminación de las bacterias de la mucosa intestinal, solo aparece en presencia de IgA, pero no en presencia de IgG que puede eventualmente llegar al intestino, destacando así la mayor capacidad de unión al patógeno de la IgA secretora sobre otras inmunoglobulinas.
Por lo demás, la colonización temprana del pollito con la vacuna viva administrada por vía oral trae, además de una mayor producción de esta IgA secretora a medida que dosis posteriores son administradas, el beneficio de un efecto controlado de inhibición de la colonización por una bacteria beneficiosa que compite con las bacterias de campo en el intestino.
Después de la administración en la mucosa de la vacuna viva atenuada de Salmonella, estas IgAs se producen y estarán presentes en el intestino, entre otros órganos, durante un período de tiempo limitado, pero aún se pueden producir posteriormente de manera constante, en caso de que las bacterias de campo lleguen al intestino.
Así como se miden anticuerpos circulantes en el suero para detectar múltiples enfermedades, con una fuerte correlación con la protección, la medición de anticuerpos intestinales también determina la protección completa de la mucosa y consecuentemente de las aves.
La certeza de que la vacuna viva bivalente puede llevar a la neutralización de Salmonella en su principal sitio de colonización, el intestino, puede entonces evaluarse por la presencia de IgA a través de hisopados cloacales.
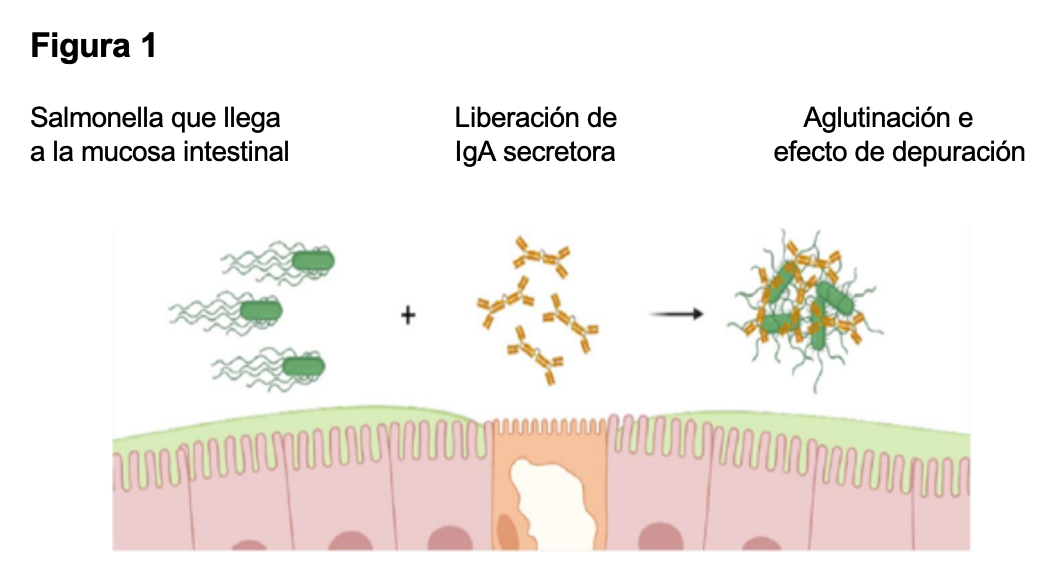
En la figura 1 se ha ilustrado el efecto de aglutinación esperado por la presencia de IgAs en las mucosas cuando neutraliza la Salmonella en su sitio de entrada. Técnicas de biología molecular muestran que justo después de que el animal ingiere Salmonella del medio ambiente, esta se encuentra en abundancia en el íleon en 20 minutos y en el ciego en 40 minutos.
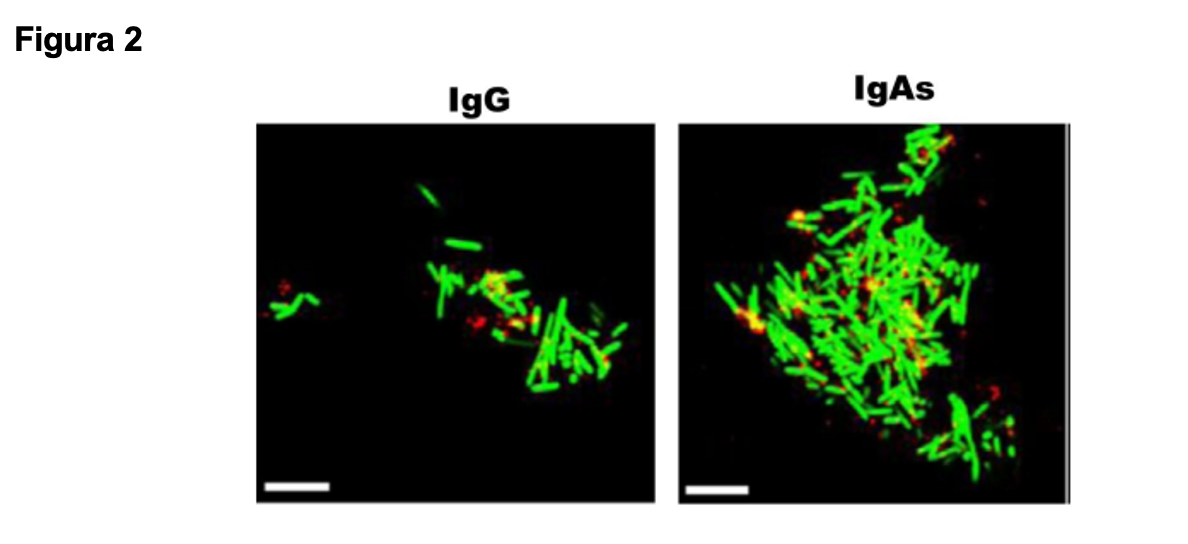
En la figura 2, la técnica cromogénica muestra el efecto de aglutinación real en el íleon y en el ciego a los 40 minutos, lo que inhibe la colonización o invasión por este efecto neutralizante. La capacidad aglutinante de la IgG se evidenció más baja en concentración y más limitada en el tiempo, en comparación con la IgA.
Teniendo en cuenta lo anterior, la investigación experimental sugiere que la inmunización avícola con una vacuna viva bivalente es capaz de inducir un mayor número más alto de títulos de IgA, a medida que se administran dosis posteriores.
CONCLUSIÓN
- En esta revisión técnica se expusieron los principales conceptos que abordan la relevancia de la IgA secretora, el mecanismo por el cual se confiere inmunidad local y el enfoque experimental para medir la respuesta, en términos de títulos de IgA, derivada de una vacuna viva bivalente de Salmonella.
- En este contexto, al elegir el programa de vacunación adecuado para reproductoras y ponedoras, la respuesta local debe considerarse como el principal impulsor de la defensa específica local, que es complementaria a la defensa sistémica desencadenada por la respuesta mediada por células.
- Se espera que el nivel de respuesta de la sIgA esté directamente influenciado por la cantidad del antígeno de la vacuna viva y el número de dosis que se administran.
- Se espera que una vacuna viva con dos antígenos (bivalente) desencadene títulos más altos en comparación con una vacuna viva con un antígeno (monovalente).
- Cuantas más dosis se administren, mayor y más prolongada será la respuesta de la IgA derivada de la vacunación a lo largo del tiempo.
- Sobre la base de este razonamiento, la IgA secretora desencadenada por la vacuna viva bivalente administrada por vía oral, debido al aumento de los títulos de IgA, impedirá la excreción y la diseminación de cepas de campo de Salmonella a lo largo del tiempo, reduciendo la presión de infección en el entorno que rodea a una parvada en particular.
BIBLIOGRAFIA
- Downing, T., Andrew, T. L., O'Farrelly, C., Bradley, D. G. The Differential Evolutionary Dynamics of Avian Cytokine and TLR Gene Classes. The Journal of Immunology - 184:6993-7000, 2010. (REF-11165)
- Geuking, M. B., McCoy, K. D., Macpherson, A. J. The function of secretory IgA in the context of the intestinal continuum of adaptive immune responses in host-microbial mutualism (REF-11180).
- Macpherson, A. J., McCoy, K. D., Johansen, F. E., Brandtzaeg, P. The immune geography of IgA induction and function. Nature- 1: 11-22, 2008 (REF-11234).
